● 고양공장 관리이사 채용 (1명)

당사는 마취 및 통증 치료에 사용되는 의료장비 및 소모품을 제조 및 수출하는 글로벌 의료기기 전문 기업입니다. 의료기기 Class IIb 제품을 주로 생산하며, 해당 제품의 안전성과 유효성을 보장하기 위해 ISO 13485, MDR(EU Medical Device Regulation), MDSAP(Medical Device Single Audit Program), cGMP(Current Good Manufacturing Practice), FDA 21 CFR Part 820 등 글로벌 규제 및 품질 시스템을 철저히 준수하고 있습니다.
특히, 의료기기 Class IIb 제품의 특성상, 다음과 같은 규정 및 심사를 정기적으로 수행하고 있습니다.
- ISO 13485: 의료기기 품질경영시스템(QMS) 운영 및 유지
- MDR(EU 2017/745): 유럽 의료기기 규정 준수를 위한 기술문서(Technical File) 작성, 인증기관(Notified Body, NB) 심사, CE 인증 획득
- MDSAP: 미국(FDA), 캐나다(Health Canada), 브라질(ANVISA), 호주(TGA), 일본(PMDA) 등 5개국의 의료기기 규제 준수
- FDA 21 CFR Part 820(QSR): 미국 FDA의 품질시스템(QSR) 규정 준수 및 510(k) 또는 PMA 승인 관리
- cGMP(Current Good Manufacturing Practice): 제조 공정의 일관성과 품질을 보장하는 우수제조관리기준 적용
- 설계 검증(Design Verification) 및 설계 밸리데이션(Design Validation) 수행
- 임상 평가(Clinical Evaluation) 및 생물학적 안전성 평가(Biocompatibility Test) 진행
- PMS(Post-Market Surveillance, 시판 후 감시) 및 PMCF(Post-Market Clinical Follow-up) 운영
- 위험 관리(Risk Management, ISO 14971) 체계 구축 및 유지
- 소프트웨어가 포함된 제품의 경우, IEC 62304에 따른 소프트웨어 밸리데이션 수행
현재 공장에는 관리직 50명, 생산직 약 250명이 근무하고 있으며, 지속적인 성장과 글로벌 시장 확대를 위해 생산 공정 전반을 총괄할 관리이사급 인재를 모십니다.
문화 및 복지
- 자유롭게 출근 시간을 조정할 수 있는 시차 출퇴근제 (08:30 / 09:00 / 09:30 중 택1) 시행
- 구내 식당 점심 지원 및 야근 시 야근 식대 제공
- 월간 부서비 지원
- 자유로운 연차 사용
- 어학비 지원
- SaaS 플랫폼 구축 (Notion, Teams etc.)
- 체계적인 온보딩 프로세스

모집 부문
- 직책: 생산본부 관리이사
- 근무지: 본사 공장 (경기 고양시 덕양구 내유길124번길 33)
- 고용 형태: 정규직
- 소속: 생산본부
- 직급: 임원급 (협의 가능)
- 급여: 면접 후 협의
주요 업무
공장장은 제조 공정 전반을 관리하며, 생산 효율성 및 품질 향상을 위해 전략적인 리더십을 발휘하는 역할을 합니다.
① 생산 및 품질 관리
- 의료기기 Class IIb 제품의 제조 공정 총괄 및 생산 일정 계획 수립
- ISO 13485, MDR, MDSAP, FDA 21 CFR Part 820 및 cGMP 규정 준수를 위한 품질 관리 및 개선
- 생산성 향상을 위한 공정 개선(Lean Manufacturing, Six Sigma) 및 원가 절감 활동 주도
② 규제 및 인증 대응
- MDR, MDSAP, FDA, cGMP 등 글로벌 규제 준수를 위한 공정 및 품질 시스템 유지 및 관리
- CE 인증 및 FDA 510(k)/PMA 승인 유지 및 심사 대응
- 내부 및 외부 감사(ISO 13485, MDSAP, FDA 등) 준비 및 대응
③ 인력 및 조직 관리
- 생산직 및 관리직 직원 300명 이상 조직 운영 및 팀워크 강화
- 직원 교육 및 역량 강화 프로그램 운영
④ 설비 및 안전 관리
- 생산설비 유지보수 및 신규 도입 검토
- 작업장 내 안전 및 환경 보호 규정 준수 (EHS 관리)
⑤ 경영진 보고
- CEO 및 임원진에게 생산 및 운영 현황 보고
- 생산성과 품질 개선을 위한 전략적 기획 및 실행
자격 요건
- 의료기기, 제약, 또는 정밀 제조업 공장 운영 및 생산 관리 경험 15년 이상
- ISO 13485, MDR, MDSAP, FDA 21 CFR Part 820, cGMP 등 의료기기 규정 및 품질관리 시스템에 대한 높은 이해
- 200명 이상의 대규모 생산 조직 관리 경험
- 리더십 및 조직 관리 역량 (팀워크, 커뮤니케이션, 문제 해결 능력)
- 제조 공정 개선 및 원가 절감 프로젝트 수행 경험
- 학사 이상 (기계공학, 산업공학, 생명공학, 화학공학, 또는 관련 전공)
우대 사항
- 의료기기 Class IIb 제조 공장 운영 경험 보유자
- Lean, Six Sigma, TPM 등의 제조 혁신 활동 경험자
- 의료기기 규제 심사(FDA, CE, MDSAP) 대응 경험자
- 영어 가능자 (해외 규제 대응 및 수출 관련 업무 수행 가능)
- ERP/MES 시스템 운영 경험 보유자
지원 방법
- 당사 채용 페이지(acemedical.career.greetinghr.com) 에서만 접수, 개별 e-mail 접수 불가
- 홈페이지 접속>공고 열람>`지원하기` 클릭 후 인적 사항 및 입사 지원서 작성
- 제출 서류: 이력서 및 자기소개서 (경력 및 리더십 경험 포함)
- 모집 기간 : 25.12.18.(목) ~ 26.01.17.(토)
- 전형 절차
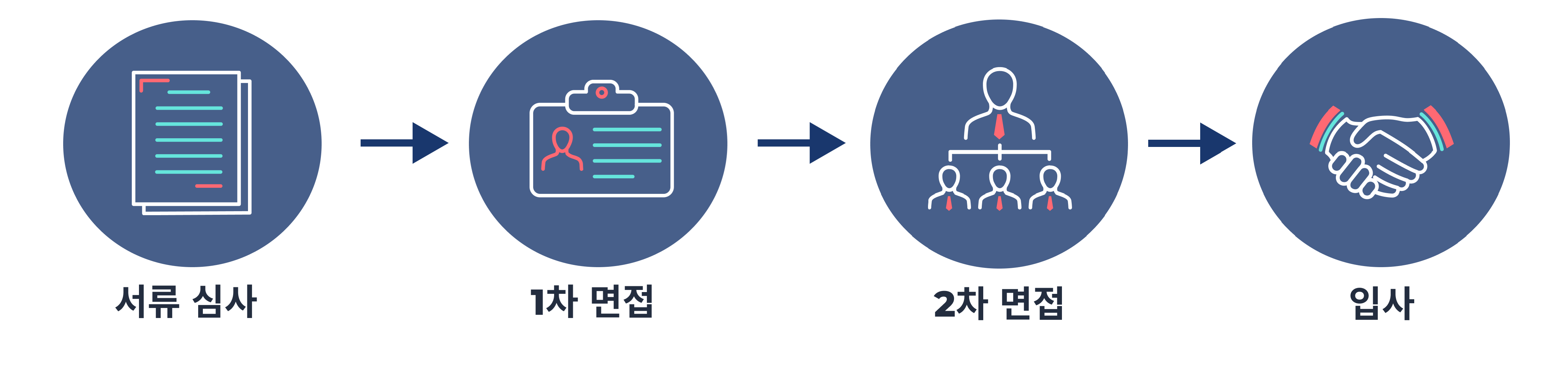
- 각 전형 별 결과는 e-mail로 개별 통지할 예정입니다.
- 상황에 따라 전형 절차가 추가 또는 생략될 수 있습니다.
- 1차 인터뷰 (직무 및 업무 역량 인터뷰)
- 해당 직군과 업무 연관성이 높은 팀원 및 소속 부서장과 함께 하는 실무 위주 인터뷰입니다.
- 지원자의 열정 및 전략적 사고 역량 및 업무 역량을 파악하는 인터뷰입니다.
- 2차 인터뷰 (컬쳐 핏 인터뷰)
- 1차 합격자를 대상으로 이루어지는 심층 인터뷰로, 조직 문화 적합도를 확인하는 인터뷰입니다.
기타 사항
- 국가 등록 장애인 및 국가 보훈대상자는 관련 법에 의거하여 우대합니다.
- 지원서 상 허위 기재가 있거나 제출한 서류가 허위일 경우 채용이 취소될 수 있습니다.
- 경력 지원자의 경우, 전 직장의 영업 비밀에 대한 침해 문제가 발생하지 않도록 유의하시기 바랍니다.
주요 참고 사항
- 제출해주신 이력서, 포트폴리오를 내부 검토하는 데에는 수 일간의 시간이 소요될 수 있습니다.
- 정규직 채용의 경우, 3개월 간의 수습기간 후 업무 역량 평가를 통해 정규직 전환을 결정합니다.
- (수습기간 급여 100% 지급)
● 고양공장 관리이사 채용 (1명)

당사는 마취 및 통증 치료에 사용되는 의료장비 및 소모품을 제조 및 수출하는 글로벌 의료기기 전문 기업입니다. 의료기기 Class IIb 제품을 주로 생산하며, 해당 제품의 안전성과 유효성을 보장하기 위해 ISO 13485, MDR(EU Medical Device Regulation), MDSAP(Medical Device Single Audit Program), cGMP(Current Good Manufacturing Practice), FDA 21 CFR Part 820 등 글로벌 규제 및 품질 시스템을 철저히 준수하고 있습니다.
특히, 의료기기 Class IIb 제품의 특성상, 다음과 같은 규정 및 심사를 정기적으로 수행하고 있습니다.
- ISO 13485: 의료기기 품질경영시스템(QMS) 운영 및 유지
- MDR(EU 2017/745): 유럽 의료기기 규정 준수를 위한 기술문서(Technical File) 작성, 인증기관(Notified Body, NB) 심사, CE 인증 획득
- MDSAP: 미국(FDA), 캐나다(Health Canada), 브라질(ANVISA), 호주(TGA), 일본(PMDA) 등 5개국의 의료기기 규제 준수
- FDA 21 CFR Part 820(QSR): 미국 FDA의 품질시스템(QSR) 규정 준수 및 510(k) 또는 PMA 승인 관리
- cGMP(Current Good Manufacturing Practice): 제조 공정의 일관성과 품질을 보장하는 우수제조관리기준 적용
- 설계 검증(Design Verification) 및 설계 밸리데이션(Design Validation) 수행
- 임상 평가(Clinical Evaluation) 및 생물학적 안전성 평가(Biocompatibility Test) 진행
- PMS(Post-Market Surveillance, 시판 후 감시) 및 PMCF(Post-Market Clinical Follow-up) 운영
- 위험 관리(Risk Management, ISO 14971) 체계 구축 및 유지
- 소프트웨어가 포함된 제품의 경우, IEC 62304에 따른 소프트웨어 밸리데이션 수행
현재 공장에는 관리직 50명, 생산직 약 250명이 근무하고 있으며, 지속적인 성장과 글로벌 시장 확대를 위해 생산 공정 전반을 총괄할 관리이사급 인재를 모십니다.
문화 및 복지
- 자유롭게 출근 시간을 조정할 수 있는 시차 출퇴근제 (08:30 / 09:00 / 09:30 중 택1) 시행
- 구내 식당 점심 지원 및 야근 시 야근 식대 제공
- 월간 부서비 지원
- 자유로운 연차 사용
- 어학비 지원
- SaaS 플랫폼 구축 (Notion, Teams etc.)
- 체계적인 온보딩 프로세스

모집 부문
- 직책: 생산본부 관리이사
- 근무지: 본사 공장 (경기 고양시 덕양구 내유길124번길 33)
- 고용 형태: 정규직
- 소속: 생산본부
- 직급: 임원급 (협의 가능)
- 급여: 면접 후 협의
주요 업무
공장장은 제조 공정 전반을 관리하며, 생산 효율성 및 품질 향상을 위해 전략적인 리더십을 발휘하는 역할을 합니다.
① 생산 및 품질 관리
- 의료기기 Class IIb 제품의 제조 공정 총괄 및 생산 일정 계획 수립
- ISO 13485, MDR, MDSAP, FDA 21 CFR Part 820 및 cGMP 규정 준수를 위한 품질 관리 및 개선
- 생산성 향상을 위한 공정 개선(Lean Manufacturing, Six Sigma) 및 원가 절감 활동 주도
② 규제 및 인증 대응
- MDR, MDSAP, FDA, cGMP 등 글로벌 규제 준수를 위한 공정 및 품질 시스템 유지 및 관리
- CE 인증 및 FDA 510(k)/PMA 승인 유지 및 심사 대응
- 내부 및 외부 감사(ISO 13485, MDSAP, FDA 등) 준비 및 대응
③ 인력 및 조직 관리
- 생산직 및 관리직 직원 300명 이상 조직 운영 및 팀워크 강화
- 직원 교육 및 역량 강화 프로그램 운영
④ 설비 및 안전 관리
- 생산설비 유지보수 및 신규 도입 검토
- 작업장 내 안전 및 환경 보호 규정 준수 (EHS 관리)
⑤ 경영진 보고
- CEO 및 임원진에게 생산 및 운영 현황 보고
- 생산성과 품질 개선을 위한 전략적 기획 및 실행
자격 요건
- 의료기기, 제약, 또는 정밀 제조업 공장 운영 및 생산 관리 경험 15년 이상
- ISO 13485, MDR, MDSAP, FDA 21 CFR Part 820, cGMP 등 의료기기 규정 및 품질관리 시스템에 대한 높은 이해
- 200명 이상의 대규모 생산 조직 관리 경험
- 리더십 및 조직 관리 역량 (팀워크, 커뮤니케이션, 문제 해결 능력)
- 제조 공정 개선 및 원가 절감 프로젝트 수행 경험
- 학사 이상 (기계공학, 산업공학, 생명공학, 화학공학, 또는 관련 전공)
우대 사항
- 의료기기 Class IIb 제조 공장 운영 경험 보유자
- Lean, Six Sigma, TPM 등의 제조 혁신 활동 경험자
- 의료기기 규제 심사(FDA, CE, MDSAP) 대응 경험자
- 영어 가능자 (해외 규제 대응 및 수출 관련 업무 수행 가능)
- ERP/MES 시스템 운영 경험 보유자
지원 방법
- 당사 채용 페이지(acemedical.career.greetinghr.com) 에서만 접수, 개별 e-mail 접수 불가
- 홈페이지 접속>공고 열람>`지원하기` 클릭 후 인적 사항 및 입사 지원서 작성
- 제출 서류: 이력서 및 자기소개서 (경력 및 리더십 경험 포함)
- 모집 기간 : 25.12.18.(목) ~ 26.01.17.(토)
- 전형 절차

- 각 전형 별 결과는 e-mail로 개별 통지할 예정입니다.
- 상황에 따라 전형 절차가 추가 또는 생략될 수 있습니다.
- 1차 인터뷰 (직무 및 업무 역량 인터뷰)
- 해당 직군과 업무 연관성이 높은 팀원 및 소속 부서장과 함께 하는 실무 위주 인터뷰입니다.
- 지원자의 열정 및 전략적 사고 역량 및 업무 역량을 파악하는 인터뷰입니다.
- 2차 인터뷰 (컬쳐 핏 인터뷰)
- 1차 합격자를 대상으로 이루어지는 심층 인터뷰로, 조직 문화 적합도를 확인하는 인터뷰입니다.
기타 사항
- 국가 등록 장애인 및 국가 보훈대상자는 관련 법에 의거하여 우대합니다.
- 지원서 상 허위 기재가 있거나 제출한 서류가 허위일 경우 채용이 취소될 수 있습니다.
- 경력 지원자의 경우, 전 직장의 영업 비밀에 대한 침해 문제가 발생하지 않도록 유의하시기 바랍니다.
주요 참고 사항
- 제출해주신 이력서, 포트폴리오를 내부 검토하는 데에는 수 일간의 시간이 소요될 수 있습니다.
- 정규직 채용의 경우, 3개월 간의 수습기간 후 업무 역량 평가를 통해 정규직 전환을 결정합니다.
- (수습기간 급여 100% 지급)